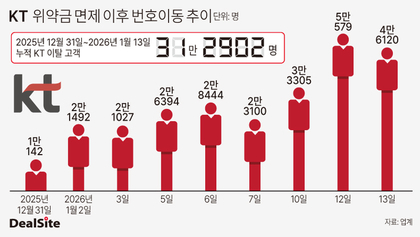
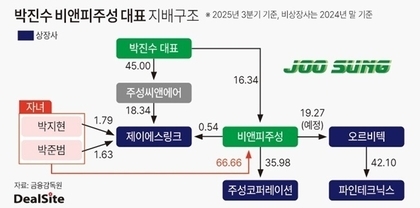
[딜사이트 방태식 기자] 알테오젠의 플랫폼 'ALT-B4'를 적용한 글로벌 블록버스터 면역항암제 '키트루다' 피하주사(SC) 제형이 유럽에서 품목허가를 획득했다. 앞서 올 9월 미국 식품의약국(FDA)로부터 승인을 획득한 데 이어 두 달 만에 추가 성과다.
알테오젠은 파트너사 MSD가 유럽연합 집행위원회(EC)로부터 '키트루다 SC'(성분명 pembrolizumab and berahyaluronidase alfa-pmph)의 품목허가를 획득했다고 19일 밝혔다. 키트루다 SC에 활용된 베라히알루로니다제 알파(제품명 ALT-B4)는 알테오젠이 개발·제조한 인간 히알루로니다아제로 기존 정맥주사 제형의 의약품을 피하주사 제형으로 전환할 수 있도록 돕는 핵심 기술이다.
이번 승인은 MSD가 올 9월 유럽 의약품청(EMA) 산하 약물사용 자문위원회(CHMP)로부터 키트루다 SC에 대한 품목 허가 긍정 의견을 획득한 후 이어졌다. 특히 키트루다의 33개 적응증 모두에서 사용이 허가됐다. 알테오젠 측은 ALT-B4가 적용된 제품이 미국에 이어 유럽 시장에서도 상업화 국면에 진입했다는 점에서 의미가 크다고 강조했다.
키트루다 SC는 기존 정맥주사(IV) 제형 대비 투약 시간이 획기적으로 단축되고 편의성이 높은 것으로 알려졌다. SC 제형은 3주 1회 투여 시 약 1분, 6주 1회 투여 시 약 2분의 짧은 투약시간이 소요된다는 점에서 IV와 달리 인퓨전 센터(infusion center) 외에도 일반 의원 및 지역 클리닉 등 다양한 의료 환경에서 투약이 가능하다. 이를 통해 환자 접근성을 크게 향상시켰다는 회사 측 설명이다.
MSD는 올 9월 FDA로부터 키트루다 SC에 대한 허가를 받아 미국 내 상업화를 개시했다. 회사는 향후 유럽연합(EU) 27개국 및 아이슬란드, 리히텐슈타인, 노르웨이 등 국가에 순차적으로 키트루다SC를 출시할 예정이다.
박순재 알테오젠 대표이사는 "ALT-B4가 적용된 키트루다 SC가 미국에 이어 유럽에서도 승인을 받음으로써 주요 의약품 시장에서 널리 사용될 것으로 기대한다"며 "이번 성과는 기존 기술수출 파트너사와의 협력은 물론 신규 파트너사에게도 신뢰할 수 있는 중요한 레퍼런스로 작용해 향후 파트너십 확대에 긍정적인 영향을 줄 것"이라고 밝혔다.
한편 알테오젠은 2020년 6월 MSD와 라이선스 계약을 체결하며 ALT-B4에 대한 사용권을 부여했다. 이후 2024년 2월 MSD의 펨브롤리주맙(pembrolizumab)의 독점적 라이선스를 위해 원계약의 일부를 변경하며 키트루다 SC에 대한 추가 마일스톤과 로열티를 수령할 수 있게 됐다.
ⓒ새로운 눈으로 시장을 바라봅니다. 딜사이트 무단전재 배포금지

 Home
Home