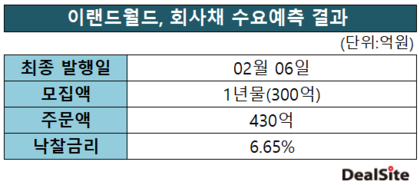
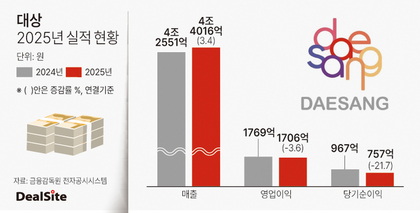
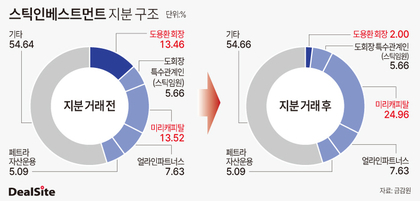
HLB "美 FDA '리보세라닙' 본심사 돌입"
NDA 제출 이틀 만에 착수…올해 7월 내 허가 여부 결정

[딜사이트 방태식 기자] HLB의 간암 신약 '리보세라닙'이 미국시장 진출을 위한 본심사에 돌입했다. 본심사 개시에 따라 리보세라닙은 오는 7월 내 허가 여부가 결정될 예정이다.
HLB는 미국 계열사 엘레바 테라퓨틱스(엘레바)가 미국 식품의약국(FDA)로부터 리보세라닙에 대한 본심사 착수 통보를 받았다고 29일 밝혔다.
엘레바는 리보세라닙에 대한 신약허가 신청서(NDA)를 제출한 지 2영업일 만에 본심사 착수를 통보받았다. 앞서 엘레바와 파트너사인 항서제약은 23일(미국 현지시간) FDA에 리보세라닙과 캄렐리주맙의 병용 요법에 대한 허가를 재신청했다.
FDA는 이번 허가 신청을 Class2로 분류해 통보했다. 이는 지난 심사 과정에서 지적됐던 항서제약 캄렐리주맙의 제조·품질관리(CMC) 부분을 확인하기 위한 목적으로 풀이된다. Class2로 분류됨에 따라 리보세라닙의 최종 허가 여부는 오는 7월23일 내로 결정될 예정이다.
김동건 엘레바 대표는 "파트너사인 항서제약과 긴밀히 협력해 제조시설 실사를 포함한 심사 전 과정에 끝까지 만전을 기할 것"이라며 "FDA와도 적극적으로 소통하며 목표하는 성과를 달성하는 데 집중하겠다"고 밝혔다.
ⓒ새로운 눈으로 시장을 바라봅니다. 딜사이트 무단전재 배포금지

관련종목
 Home
Home