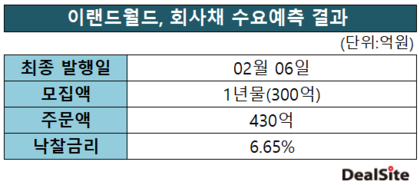
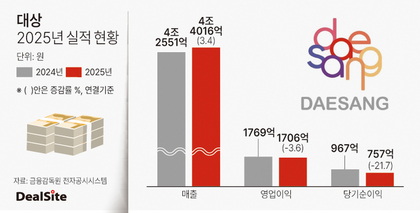
[딜사이트 최광석 기자] 프레스티지바이오파마가 개발한 허셉틴 바이오시밀러 '투즈뉴'(Tuznue, 성분명 트라스트주맙)의 유럽 출시가 지연되고 있다. 앞서 2024년 9월 최종 승인을 획득했지만 파트너사 선정 등 상업화를 위한 후속작업이 늦어지고 있어서다. 나아가 이미 출시된 경쟁 제품들이 다수 존재함에 따라 시장 안착과 함께 수익성 확보가 쉽지 않을 것이라는 전망도 고개를 들고 있다.
2일 업계에 따르면 투즈뉴는 2024년 9월23일 유럽연합 집행위원회(EC)로부터 최종 품목허가를 획득했다. 국내에서 삼성바이오에피스, 셀트리온에 이어 세 번째 허셉틴 바이오시밀러 허가를 획득한 셈이다.
투즈뉴의 오리지널 허셉틴은 글로벌 제약사 '로슈(Roche)'가 개발한 유방암과 전이성 위암 치료제다. 현재 허셉틴의 전세계 시장 규모는 5조5000억원으로 추산되며 오는 2028년 10조원, 2030년 13조원까지 커질 것으로 전망된다. 프레스티지바이오파마는 유럽과 미국을 포함해 글로벌 점유율 10% 달성을 목표로 하고 있다.
하지만 유럽 품목허가 이후 상업화와 관련한 소식은 잠잠하다. 앞서 박소연 프레스티지바이오그룹 회장은 작년 8월 열린 기업설명회에서 허셉틴을 판매할 유럽 파트너사 후보군을 3개 정도로 축약했으며 그 중 두 곳은 연 3조원 이상의 매출을 내는 회사라고 설명했다. 또 튜즈뉴 정식 승인에 맞춰 파트너사를 최종 결정하고 계약을 맺을 예정이라고 밝혔다.
다만 이와 관련해 최근 회사 측은 "8개 중 3개로 정리된 잠재 계약사 중 유통망이 가장 많고 마케팅 능력을 갖춘 강력한 글로벌 빅파마로 파트너사를 압축했다"며 "박소연 회장이 '세계 제약바이오 전시회(CPHI) 2024'에서 잠재 계약사와 미팅을 진행하고 구체적인 협의를 거쳐 최종 계약을 앞두고 있다"고 밝혔다. 아직 파트너사 선정과 관련해 큰 진척을 보이지 못하고 있는 셈이다.
파트너사와 계약을 맺고 제품을 출시한다 해도 시장 공략에 다소 시간이 소요될 것이라는 전망도 나오고 있다. 투즈뉴가 후발주자인 탓에 앞서 허가를 받은 허셉틴 바이오시밀러 7개 제품과 경쟁을 벌어야 하는 까닭이다. 더욱이 의료비 절감을 위해 유럽에서 바이오시밀러 사용을 장려하고 있다는 점에서 향후 경쟁이 더욱 치열해질 것이라는 관측이다.
이미 승인된 허셉틴 바이오시밀러는 ▲셀트리온 '허쥬마' ▲삼성바이오에피스 '온트루잔트' ▲화이자 '트라지메라' ▲마일란 '오기브리' ▲암젠 '칸진티' ▲산도즈 '허웬다' ▲제르시팩 '헨리우스' 등이다.
프레스티지바이오그룹은 가격경쟁력을 투즈뉴의 최대 강점으로 꼽고 있다. 위탁개발생산(CDMO) 자회사 '프레스티지바이오로직스'를 통해 제품을 생산하기에 경쟁 품목보다 가격을 낮출 수 있다는 계산이다.
회사 관계자는 "기존 허가를 받은 제품들이 오리지널인 허셉틴보다는 저렴하지만 각각의 전략에 따라 다양한 가격대를 형성하고 있다"며 "후발주자의 한계를 극복하기 위해 고품질 제품을 합리적인 가격에 내놓는 방향으로 (판매)전략을 수립하고 있다"고 말했다.
이어 "이 같은 전략이 시장수익률을 하회하고 마진율을 현격하게 낮추는 수준은 아니다"라며 "회사의 첫 번째 캐시카우가 될 단가"라고 덧붙였다.
하지만 여전히 시장 일각에서는 직접 판매(직판)가 아닌 파트너사를 활용할 경우 수익성이 떨어질 수 있다는 우려를 제기하고 있다.
시장 한 관계자는 "직판은 수익성을 높일 수 있지만 현지 영업조직을 갖춰야 하는 문제가 있고 파트너사를 활용할 경우 이익을 나눠야 하기 때문에 수익성이 직판보다 낮아질 가능성이 크다"며 "후발주자라고 가격경쟁력만 내세울 경우 실제 손에 남는 게 없을 수 있다"고 관측했다.
ⓒ새로운 눈으로 시장을 바라봅니다. 딜사이트 무단전재 배포금지

 Home
Home